Elektrische Energie- und Startsysteme (1) 31.01.2017, 05:28
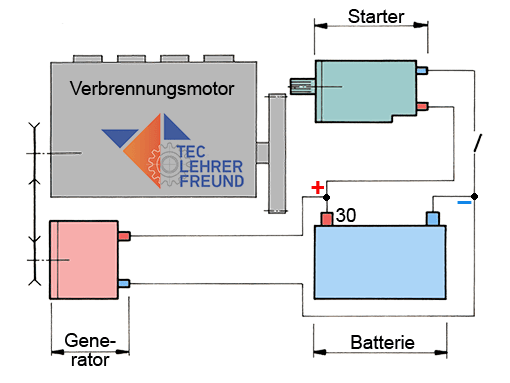
Um von Verbrennungsmotoren angetriebene Maschinen zum Laufen zu bringen und mit ihnen zu arbeiten, wird ein elektrischer Systemverbund benötigt: Batterie, Startermotor und Drehstromgenerator. Der vorliegende Beitrag erläutert den Aufbau und die Funktion der Batterie.
Fahrzeugantriebe: Elektrische Energie- und Startsysteme (1)
Alle von Verbrennungsmotoren angetriebene Geräte und Maschinen benötigen für ihren Betrieb ein System von elektrischen Hilfen. Sie bestehen aus
– der Batterie (Akkumulator, Akku) als Energiespeicher
– dem Drehstromgenerator (Lichtmaschine) als elektrisches »Kraftwerk« und
– einem Gleichstrommotor (Starter) zum Starten des Verbrennungsmotors.
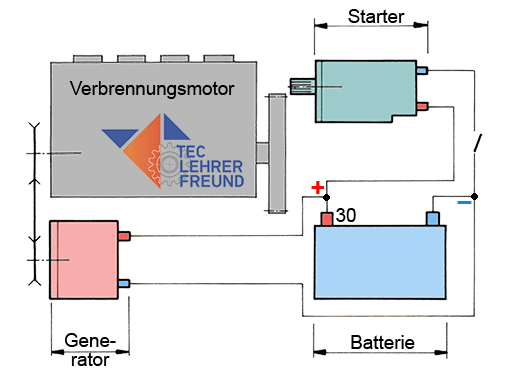
Bild 1: Zusammenwirken von Batterie, Starter und Generator
Die traditionellen Aufgaben von Batterie, Generator und Starter haben sich trotz vielfältiger technischer Fortschritte kaum verändert. Dagegen gab es bei den Steuerungs- und Regelungsaufgaben sowie in der Elektrolyttechnik Weiterentwicklungen.
Anmerkungen:
– Bei der Verwendung der Begriffe »Batterie« oder »Akkumulator« sind in den LF-Beiträgen wiederaufladbare Akkumulatoren auf Blei/Schwefelsäure-Basis gemeint.
– Die folgende Beschreibung der elektrochemischen Spannungserzeugung setzt Grundkenntnisse der physikalischen und chemischen Grundlagen voraus.
Starterbatterie
Batterien und Akkumulatoren (Akkus) arbeiten unterschiedlich.
Jede Batterie hat einen aus Metall bestehenden Plus- und einen Minuspol, die Elektroden. Metalle bestehen aus kleinsten beweglichen Teilen, den Elektronen. Sie sind die negativ geladenen Bestandteile der Atome und Ionen. Taucht man die Elektroden in eine Säure (die in der Batterie enthaltene Elektrolytflüssigkeit), dann verändern sie ihr Verhalten. Beispiel Zink- und Kupferplatte: Zink hat überschüssige Elektronen, Kupfer könnte diese aufnehmen. Verbindet man die Metallplatten mit einem Draht, setzen sich die Elektronen sich in Bewegung. Die Batterie produziert Strom, indem sie chemische Energie in elektrische umwandelt. Bei Batterien ist das Entladen gar nicht oder nur in geringem Maße umkehrbar. Der Akkumulator dagegen kann die Entladungsreaktion einer Batterie umkehren; er wird immer wieder aufgeladen und ist deshalb sehr lange nutzbar. Im Folgenden werden die Vorgänge näher beschrieben.
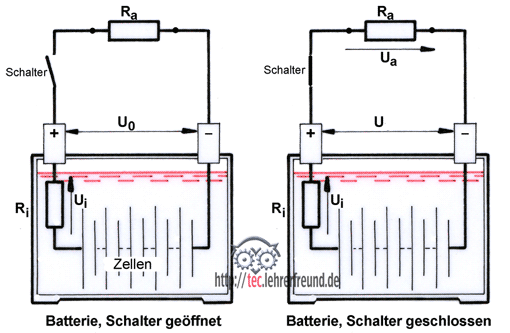
Aufgaben und Aufbau: Die Fahrzeugbatterie wird als Spannungsquelle und Energiespeicher für das Starten des Motors benötigt, aber auch zur Überbrückung, wenn der Generator nicht genügend elektrische Energie liefert. Auf jede Energieentnahme muss eine Ladeperiode folgen, damit die Batterie für weitere Bedarfsfälle einsatzbereit ist.
ln Verkehrsfahrzeugen, Traktoren, Baumaschinen und anderen Arbeitsmaschinen sind nach wie vor Blei-Säure-Batterien verbaut. Der Elektroden-Grundwerkstoff ist Blei; der Elektrolyt besteht aus mit Wasser verdünnter Schwefelsäure (Bild 2).

Bild 2: Bleiakkumulator für Kraftfahrzeuge (Bild Thomas Wydra: Bleiakkumulator für Kraftfahrzeuge, Public Domain)
In jeder der dicht verschlossenen Zellen befindet sich ein Plus-Plattensatz aus Bleioxid und ein Minus-Plattensatz aus Blei. Weil Blei und Bleidioxid in der elektrochemischen Spannungsreihe einen Spannungsunterschied von etwa 2 Volt aufbauen, müssen für eine 12 V-Batterie sechs Zellen hintereinander geschaltet werden.
Der Plus-Pol ist mit einem Pluszeichen (+) und/oder mit roter Farbe gekennzeichnet. Der Minus-Pol ist mit einem Minuszeichen (–) und/oder in schwarzer oder blauer Farbe markiert.
Die Werkstoffe der beiden Plattensätze wandeln sich während des Ladens und Entladens chemisch um. Dabei dürfen sie sich, um einen Kurzschluss zu vermeiden, gegenseitig nicht berühren. Dies ist möglich, wenn sie räumlich von einer elektrolytdurchlässigen Absperrung auf Abstand gehalten werden; man verwendet dafür Kunststoffseparatoren, Vliesschichten oder Kunststofftaschen. Als Träger des Plattenmaterials werden Bleigitter eingesetzt. Das weiche und wenig belastbare Gitterblei wird durch Legierungszusätze wie Calcium hart und stabil.
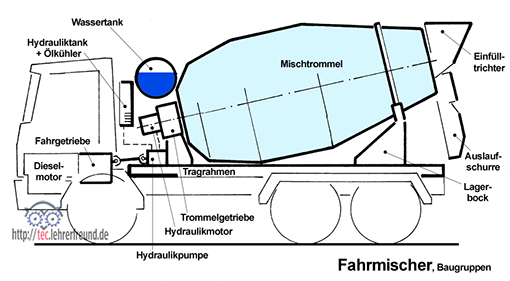
Bild: Schwere Maschinen arbeiten mit einer 24-Volt-Starteranlage
Bild 3: Die Zellen einer 12-V-Starterbatterie sind in Reihe geschaltet. Für den Antrieb großer Starter mit 24 Volt Betriebsspannung schaltet man meist zwei 12-V-Batterien in Reihe.

Bild 3
Die Batterie: Ein Chemielabor
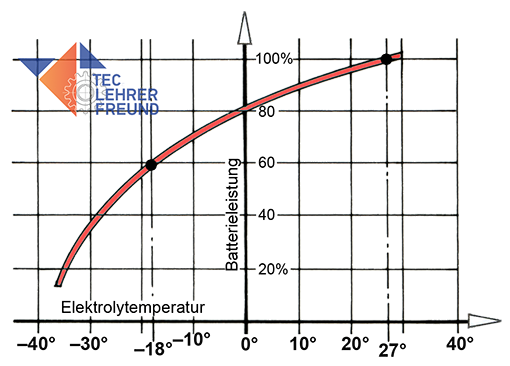
Elektrolyt: Reines Wasser hat eine Dichte von 1,0 kg/dm3. Fast doppelt so schwer ist reine Schwefelsäure mit etwa 1,84 kg/dm3. Bei einer nur noch halb geladenen Batterie liegt die Dichte bei etwas unter 1,2 kg/dm3. Die Säuredichte ist ein Maß für den Batterieladezustand.
Die Batterie wird entladen
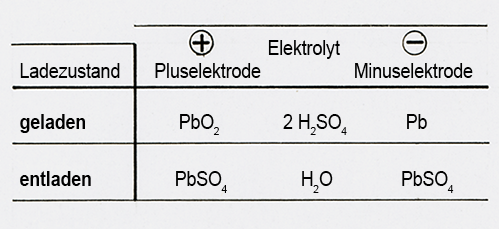
Bild 4: Im geladenen Zustand bestehen die Elektrodenplatten aus Blei Pb und Bleidioxid PbO2; PbO2 ist die positive Elektrode, Pb die negative Elektrode. Die chemischen Vorgänge, die sich während des Entladens abspielen, sind in Bild 5 schematisch dargestellt. Wenn die Batterie Strom abgibt, trennen sich an der Pluselektrode Sauerstoffatome vom Blei und gelangen in den Elektrolyten. Das Blei bleibt im Plattenmaterial:
PbO2 ––> Pb + O2
(Es ist eine Eigenheit von Sauerstoff und Wasserstoff, dass sie immer nur als Moleküle O2 und H2 vorkommen, und nicht als Einzelatome O und H).
Gleichzeitig spalten sich Schwefelsäure-Moleküle H2SO4 des Elektrolyten in Wasserstoffmoleküle H2 und in Sulfatmoleküle SO4 auf:
H2SO4 ––> H2 + SO4
Die Wasserstoffmoleküle H2 verbinden sich mit frei gewordenen Sauerstoffatomen und bilden Wasser H2O:
2H2 + O2 ––> 2 H2O
Die aus dem Elektrolyten frei gewordenen Sulfatmoleküle SO4 verbinden sich mit dem inzwischen reinen Blei der Pluselektrode und dem reinen Blei der Minuselektrode jeweils zu Bleisulfat PbSO4:
Pb + SO4 ––> PbSO4
Bild 5: Mit fortschreitender Entladung setzt sich der chemische Umwandlungsprozess immer weiter fort. Dadurch entsteht zunehmend gleiches Plattenmaterial in den Elektroden, während die Ausgangsspannung und damit die Leistung der Batterie sinkt. Zwischen gleichen Stoffen entsteht keine elektrische Spannung; so kann auch zwischen den Bleisulfat-Molekülen PbSO4 der Pluselektrode und den Bleisulfat-Molekülen der Minuselektrode keine elektrische Spannung mehr entstehen.
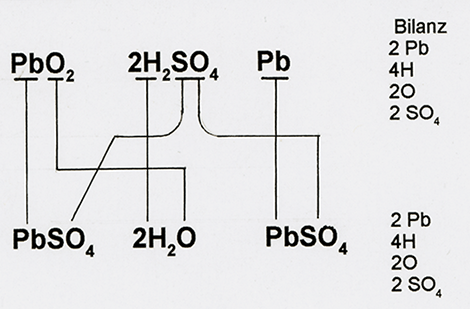
Bild 5: Zwischen gleichen Stoffen entsteht keine elektrische Spannung
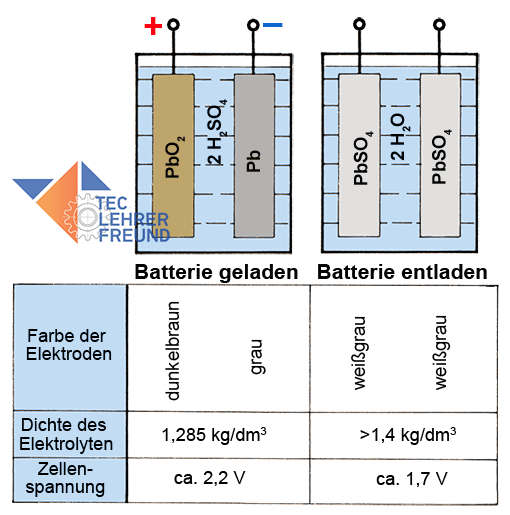
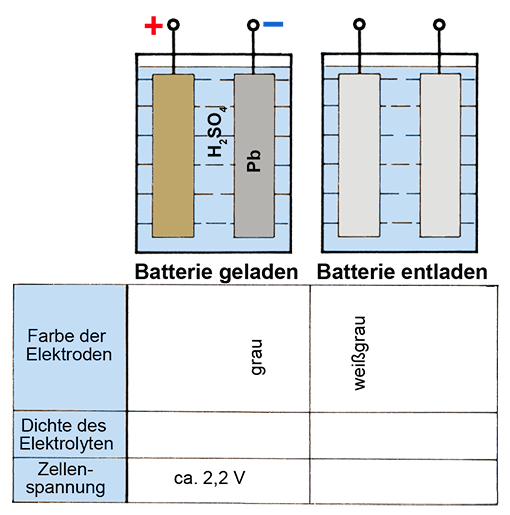
Bild 6: Zelleneingenschaften in der geladenen und entladenen Batterie
Die Batterie wird geladen
Beim Laden mit Gleichstrom laufen die beim Entladen beschriebenen chemischen Vorgänge in umgekehrter Richtung ab. Dabei werden die aktiven Stoffe PbO2 und Pb aus PbSO4 wieder aufgebaut.
Beide mit Bleisulfat besetzte Plattenelektroden geben unter dem Druck der Ladespannung Sulfat-Moleküle SO4 an die Batterieflüssigkeit ab. Gleichzeitig spaltet die Ladespannung auch Wassermoleküle des Elektrolyten in Wasserstoff H2 und Sauerstoff O2 auf. Der so entstehende Wasserstoff verbindet sich sofort mit den entstehenden Sulfat-Molekülen zu Schwefelsäure-Molekülen H2SO4. Die Minuselektrode bleibt nach Abgabe des Sulfat-Moleküls als reine Bleielektrode zurück. Die Pluselektrode nimmt nach Abgabe des Sulfat-Moleküls den Sauerstoff auf und wird zu Bleidioxid PbO2.
So lange die Ladespannung pro Zelle 2,35 V bis 2,40 V nicht überschreitet, besteht bei wartungsarmen und wartungsfreien Batterien ein Gleichgewicht zwischen diesen chemischen Vorgängen.
Wird beim Laden eine über 2,4 V liegende Spannung angelegt, spaltet sich das Wasser zu schnell. Es entsteht mehr Sauerstoff als das Blei der Pluselektrode in der gleichen Zeit aufnehmen kann und auch mehr Wasserstoff als die Sulfat-Molekülen aufnehmen können. Überschüssiger Sauerstoff und Wasserstoff entweichen sprudelnd aus dem Elektrolyten: die Batterie »kocht«. Freier Sauerstoff und Wasserstoff bilden Knallgas, das an sehr heißen Leitungsstellen wie etwa losen Kontakten, Kontaktfunken, Kurzschlussfunken oder offener Glut explodieren kann.
Man kann die Blei-Säure-Batterien unterscheiden in herkömmliche, wartungsarme und wartungsfreie Batterien.
Aufgaben zur Vertiefung dieses Stoffs
1. Ergänzen Sie das folgende Bild:
– Wie heißen die dargestellten Baugruppen?

2. Erklären Sie/schreiben Sie die folgenden Stoffe mit ihren chemischen Kurzzeichen:
– Bleioxid
– Bleisulfat
– Elektrode
– Elektrolyt
– Knallgas
– Schwefelsäure
– Sulfatmolekül
3. Ergänzen bzw. berichtigen Sie das folgende Schema:
Lösungsvorschläge
1. Siehe Bild 1 im Beitrag
2. – Blei = Schwermetall
– Bleioxid = PbO2
– Bleisulfat = PbSO4
– Elektrode = ein Elektronenleiter, der zusammen mit einer Gegenelektrode mit einem zwischen beiden Elektroden befindlichen Medium in Wechselwirkung steht
– Elektrolyt = eine chemische Verbindung, die im festen, flüssigen oder gelösten Zustand in Ionen dissoziiert ist und den elektr. Strom leitet
– Knallgas = Mischung aus H2 und O2
– Schwefelsäure = H2SO4
– Sulfatmoleküle = SO4
3. Siehe Bild 6 im Beitrag